NOMENCLATURA DE ALCOHOLES Y FENOLES
ALCOHOLES Y FENOLES
LAURA MARIANA ORREGO GARCÉS
Informe de laboratorio realizado en la clase de química, orientada por la docente
Esp. DIANA FERNANDA JARAMILLO CÁRDENAS
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
ÁREA DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL
IBAGUÉ
2019
2019
INTRODUCCIÓN
Este informe tiene como finalidad instruir al lector acerca de los Alcoholes y Fenoles. Contiene marco teórico que permitirá adquirir nuevos conocimientos, y aclaramiento de dudas, finalmente este contenido se pondrá en practica con la realización de varios ejercicios y su respectiva corrección.
OBJETIVOS
- Permitir que el lector identifique y aprenda de forma didáctica la nomenclatura de los Alcoholes y Fenoles.
- Familiarizar al lector con la nomenclatura de Alcoholes y Fenoles para que lo pueda aplicar y comprender por medio de su respectiva practica.
- Satisfacer las necesidades del lector de acuerdo a los temas pertinentes.
NOMENCLATURA DE ALCOHOLES Y FENOLES
“Los alcoholes son compuestos orgánicos que contienen grupos hidroxilo, es decir, un — OH.”
A partir de los alcoholes, también se pueden obtener muchos compuestos con diferentes grupos funcionales. Su estructura, es similar a la del agua, solo que se reemplaza uno de los átomos de hidrógeno del agua, por un grupo alquilo.
Como todo en la vida, los alcoholes también tienen categorías, ya que encontramos los grupos hidroxilo unidos a diferentes estructuras; una forma de organizarlos, es basándose en el tipo de átomo de carbono al que esta unido.

Según la estructura del carbono enlazante
Alcoholes Primarios: el Carbono enlazado al Grupo Hidroxilo tiene un sustituyente R. Ejemplos:
- CH3-CH2-OH → Etanol o Alcohol Etílico
- CH3-CH2-CH2-OH → 1-Propanol
- CH3-CH2-CH2-CH2-OH → 1-Pentanol
Alcoholes Secundarios: el Carbono enlazado al Grupo Hidroxilo tiene 2 sustituyentes R y R':

2-propanol o alcohol isopropílico
Alcoholes Terciarios: el Carbono enlazado al Grupo Hidroxilo tiene 3 sustituyentes R, R' y R'':

2-metil-2 propanol o alcohol terbutílico
Según el número de Grupos Hidroxilos
- Monoalcohol, Monol o Alcohol Monohidroxílico: formado por 1 Grupo Hidroxilo



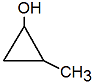
Etanol (alcohol etílico) 2-Propanol 2-metil-2propanol 1,2-Propanodiol
(alcohol isopropílico) (alcohol terbutílico)

Polialcoholes: poseen dos o más Grupos Hidroxilos
Dioles, Glicoles o Alcoholes Dihidroxílicos: 2 Grupos Hidroxilo


1,2-Etanodiol 1,2-Propanodiol
Trioles: 3 Grupos Hidroxilo

Propano-1,2,3-triol
(Glicerol o Glicerina)
Más de 3 Grupos Hidroxilo:
* C4H6(OH)4 → Butano-1,2,3,4-tetraol
* C5H7(OH)5 → Pentano-1,2,3,4,5-pentol
* C6H8(OH)6 → Hexano-1,2,3,4,5,6-hexol
* C7H9(OH)7 → Heptano-1,2,3,4,5,6,7-heptol
Propiedades de los Alcoholes
* Forman enlaces o puentes de hidrógeno que dan lugar a que sean solubles en agua y a que sus puntos de ebullición más altos que los respectivos alcanos.
* Son líquidos e incoloros a temperatura ambiente por regla general.
* Menos densos que el agua.
Las principales reacciones en las que se ven envueltos los alcoholes son:
Halogenación de alcoholes:
(H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
Oxidación de alcoholes
Deshidratación de alcoholes
Los alcoholes, son compuestos muy útiles y abundantes en la naturaleza, también tienen aplicaciones significativas para la industria y el hogar. Es uno de los términos mas antiguos de la química orgánica.
Otros Grupos Funcionales
Grupo Compuestos
Alquilo: alcanos Radicales Alquilo:
-CH3 metilo
Alquenilo: alquenos Radicales Alquenilo:
-CH=CH-CH3 1-propenilo
Alquinilo: alquinos Radicales Alquinilo:
-C≡CH etinilo
Hidroxilo: R-OH Alcoholes: CH3-OH
Alcoxi: R-O-R' Éteres: CH3−O−CH3
Entre otros...
Entonces, si nos encontramos con un grupo hidroxilo unido a un anillo aromático, se le llamara fenol.
“Los fenoles tienen propiedades similares a la de los alcoholes, pero algunas de ellas, derivan mas que nada del anillo aromático al que se encuentran enlazados.”
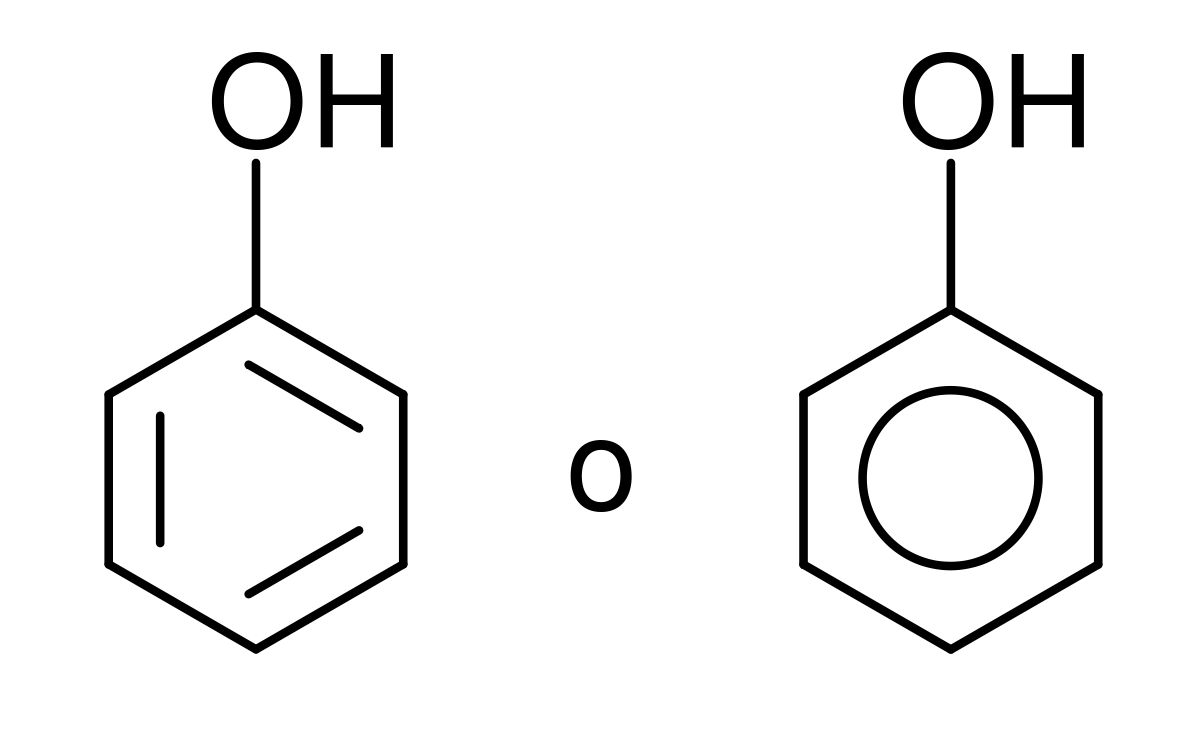
NOMENCLATURA: Reglas IUPAC
- Se nombra la cadena más larga de carbonos que contiene al átomo de carbono enlazado con el grupo — OH. En la terminación “ano”, “eno” o “ino”, se sustituye la “o” por “ol”.
- La cadena de carbonos (más larga), se nombrara comenzando por el extremo más cercano al grupo — OH. “El grupo hidroxilo tiene preferencia sobre los dobles o triples enlaces.”
* CH3-OH → metanol (aquí no es necesario indicar la posición)
* CH3-CH2-OH → etanol (aquí tampoco es necesario indicar la posición)
* CH3-CH2-CH2-OH → 1-propanol
* CH3-CHOH-CH3 → 2-propanol
* CH3-CH2-CHOH-CH3 → 2-butanol
- Se nombran los demás sustituyentes precedidos de los números de carbonos sobre los que están localizados, así como para nombrar a los alcanos o alquenos.

La cadena de carbonos más larga tiene cuatro, por lo tanto, su nombre base es butanol.
El grupo — OH se encuentra en el carbono 2, por lo que sería: butan-2-ol.Entonces, siguiendo las reglas IUPAC, el nombre de este compuesto es: 1-bromo-3,3- dimetilbutan-2-ol.
En el caso de los alcoholes ciclicos, se nombran utilizando el prejifo “ciclo”. Al carbono que este unido al grupo — OH se le da el número uno.
Los alcoholes que tienen dos grupos — OH, se llaman dioles. Y se nombran exactamente igual que los alcoholes, solo que se usará el sufijo “diol” y los numero del carbono en el que estarán, por ejemplo: “Hexa-1,5-diol”.
Para nombrar a los fenoles si se deben seguir cierto tipo de criterios, dado que incluye un anillo aromático. Con frecuencia se siguen los siguientes criterios:
- ORTO (1,2- disustituido)
- META (1,3- disustituido)
- PARA (1,4- disustituido)

Propiedades Físicas de los Fenoles
Los fenoles más simples son líquidos o sólidos de bajo punto de fusión y punto de ebullición elevado, debido al enlace de las moléculas unas a las otras, por enlaces de hidrógeno. Son en general poco solubles o insolubles en agua, de olor fuerte y característico.
Son tóxicos y tienen acción cáustica sobre la piel. A menos que exista en la molécula algún grupo susceptible de producir color, los fenoles son incoloros. Se oxidan fácilmente, con las aminas y muchos fenoles presentan color debido a la presencia de productos de oxidación coloreados.
La comparación de las propiedades físicas de los nitrofenoles isómeros hace resaltar un aspecto importante, veamos:
| isómero | PE (a 70 mmHg) | solubilidad | volatilidad en vapor de agua |
| orto-nitrofenol | 100o C | 0,2 g /100g de H2O | Volátil en vapor de agua |
| meta-nitrofenol | 194o C | 1,35 g /100g de H2O | No volátil en vapor de agua |
| para-nitrofenol | Se descompone | 1,69 g /100g de H2O | No volátil en vapor de agua |
Notamos que el orto-nitrofenol tiene un punto de ebullición bastante más bajo y mucho menor solubilidad en agua que los otros isómeros, además de ser el único fácilmente destilable en corriente de vapor de agua. ¿Cómo se explica estas diferencias?
Consideremos primeramente los isómeros meta y para. Ellos tienen puntos de ebullición más elevados debido a la existencia de enlaces de hidrógeno intermoleculares. La solubilidad más elevada se debe a la formación de enlaces de hidrógeno con las moléculas de agua.
La destilación en corriente de vapor, depende de la sustancia presentar apreciable presión de vapor a temperatura de ebullición del agua. La existencia de enlaces de hidrógeno intermoleculares impide la evaporación de los isómeros meta y para que, por tanto no destilan.
Observándose que el hidrógeno orto-nitroferol en un modelo molecular, podemos ver claramente que la pequeña distancia de los grupos NO2 y OH y sus disposiciones en el anillo favorecen la formación de enlaces de hidrógeno intramoleculares, o sea, un puente de hidrógeno dentro de la molécula.
En este isómero, por tanto, los enlaces de hidrógeno intramoleculares toman el lugar de los enlaces de hidrógeno intermoleculares.
Métodos de obtención
Muchos fenoles simples como el fenol común, los naftoles y los cresoles pueden ser obtenidos directamente del alquitrán de la hulla. Por ello en laboratorio, las reacciones generalmente objetivan la producción de fenoles con estructuras más complejas.
Propiedades químicas
Los fenoles tienen carácter relativamente ácido, sin embargo, menos ácido que los ácidos carboxílicos. Los fenoles pueden ser fácilmente diferenciados de los alcoholes por medio de algunos test simples de laboratorio.
Sales Fenoles
Como ya fue dicho, los fenoles son compuestos relativamente ácidos y pueden ser convertidos en las respectivas sales por soluciones acuosas de hidróxidos.
Estas sales son conocidas como fenóxidos o fenolatos. Como sería de esperarse los fenoles y sus sales tienen características opuestas cuanto a la solubilidad: las sales son solubles en agua e insolubles en solventes orgánicos.
La fuerza ácida de los fenoles y la solubilidad de las respectivas sales en agua pueden utilizarse tanto en análisis cuanto en separaciones. Una sustancia insoluble en agua, solubilizada por soluciones acuosas de hidróxido, pero no por soluciones acuosas de bicarbonato, tiene, en virtud de ser más ácida que el agua, pero menos ácidos que los ácidos carboxílicos; la mayoría de los compuestos en este escalón de acidez son fenoles.
Con base en la solubilidad en medio alcalino, pueden separarse los fenoles de los compuestos no ácidos por medio de la insolubilidad en bicarbonato es posible separarlos de los ácidos carboxílicos.
Aplicaciones de los Fenoles
Los fenoles encuentran diversas aplicaciones prácticas tales como:
- Desinfectantes (fenoles y cresoles)
- Preparación de resinas y polímeros
- Preparación de ácido del ácido pícrico, usado en la preparación de explosivos.
- Síntesis de la aspirina y de otros medicamentos.
Entre los dihidroxifenoles, la hidroquinona es la más importante. A partir de ella se producen las quinonas, que son compuestos coloreados, variando desde el amarillo al rojo. No presentan carácter aromático, siendo fuertemente insaturadas. La acción reductora de la hidroquinona, que a temperatura ambiente actúa con gran rapidez sobre las sales de plata, hace de ella un excelente revelador fotográfico de largo uso.
En fin, numerosos derivados de los fenoles están difundidos en toda la naturaleza. Entre estos el eugenol y el isoeugenol, que constituyen esencias del clavo y nuez moscada.
Como se nombran los Fenoles
- Se nombran como los alcoholes, con la terminación "-ol" añadida al nombre del hidrocarburo, cuando el grupo OH es la función principal. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
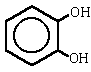
- Si el benceno tiene varios sustituyentes, diferentes del OH, se numeran de forma que reciban los localizadores más bajos desde el grupo OH, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales.
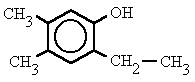
2-etil-4,5-dimetilfenol
Si nos dan el Nombre
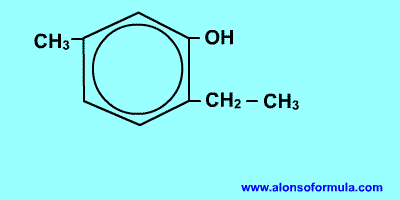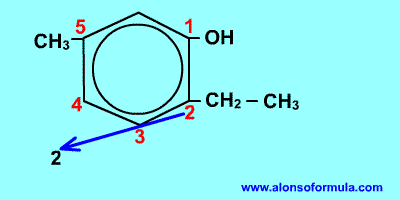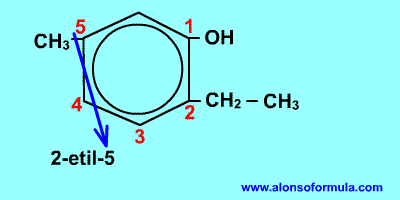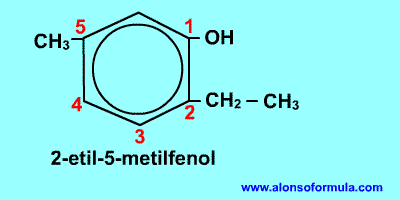
Comienza a contar por el grupo OH y en el sentido en que se consigan localizadores más bajos para los radicales. Nombra los radicales con los localizadores seguidos de benceno terminado en -ol.

Sobre el benceno coloca los localizadores para situar los radicales y los grupos OH. Completa luego los hidrógenos que falten.
Ejemplos:
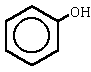 |
bencenol
hidroxibenceno(fenol) |
 |
1,2-bencenodiol
benceno-1,2-diol(pirocatecol) |
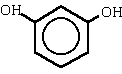 |
1,3-bencenodiol
benceno-1,3-diol(resorcinol) |
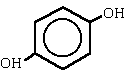 |
1,4-bencenodiol
benceno-1,4-diol(hidroquinona) |
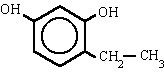 | 4-etil-1,3-bencenodiol 4-etilbenceno-1,3-diol |
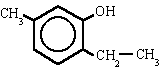 | 2-etil-5-metilbencenol |
También encontraras estos vídeos que te pueden ayudar:
https://www.youtube.com/watch?v=Exw0ZznHyQ8
https://www.youtube.com/watch?v=BfHOjvXEv5s
https://www.youtube.com/watch?v=hkBybaYyKCw
EJERCICIOS
COMPUESTOS OXIGENADOS
ALCOHOLES I
CORRECCIÓN
ALCOHOLES II
FENOLES I
CORRECCIÓN
FENOLES II
CORRECCIÓN
WEBGRAFÍA
https://medium.com/@salmaG/qu%C3%ADmica-org%C3%A1nica-nomenclatura-de-alcoholes-y-fenoles-bffaf421e43f
https://www.quimicaorganica.org/alcoholes/410-nomenclatura-de-alcoholes.html
https://es.slideshare.net/KarinaGalvez1/nomenclatura-de-alcoholes-39447497
https://www.quimicas.net/2015/05/ejemplos-de-alcoholes.html
https://quimica.laguia2000.com/conceptos-basicos/fenoles-nomenclatura-y-ejemplos
http://centros.edu.xunta.es/iesasardineira/web_CS/qo/nomenclatura/nomenorgan/oxigenados/fenoles.php
https://www.alonsoformula.com/organica/fenois.htm




















BUEN TRABAJO 5,0
ResponderEliminar