REACCIONES QUIMICAS
INFORME- LAS REACCIONES QUÍMICAS Y TODO ACERCA DE ELLAS
INTRODUCCIÓN
Este trabajo tiene como finalidad informar a los espectadores sobre las reacciones químicas, tipos de reacciones, las ecuaciones químicas, como escribir una ecuación química entre otros.
OBJETIVOS
- Familiarizar al estudiante con las reacciones químicas.
- Instruir al estudiante en las ecuaciones químicas y los tipos de reacciones químicas.
- Identificar las reacciones químicas, realizar sus ecuaciones y conocer los tipos de reacciones.
Este trabajo tiene como finalidad informar a los espectadores sobre las reacciones químicas, tipos de reacciones, las ecuaciones químicas, como escribir una ecuación química entre otros.
OBJETIVOS
- Familiarizar al estudiante con las reacciones químicas.
- Instruir al estudiante en las ecuaciones químicas y los tipos de reacciones químicas.
- Identificar las reacciones químicas, realizar sus ecuaciones y conocer los tipos de reacciones.
REACCIÓN QUÍMICA
Una reacción química es la forma en que una sustancia reacciona con otra. En una reacción química existen las sustancias que reaccionan, o sea las reactantes, y las sustancias producidas, llamadas productos.
La reacción química implica la desaparición de ciertas propiedades y el surgimiento de otras. Los enlaces que existían entre los átomos de los reactivos se quiebran, lo que lleva a una reorganización atómica y a la formación de nuevos enlaces.
Es importante destacar que, en todas las reacciones químicas, se conserva la masa (la masa de los productos es igual a la masa de los reactivos) ya que los átomos se reorganizan, pero no se eliminan ni se crean nuevos.
ECUACIÓN QUÍMICA
Una reacción química es cualquier proceso en el que, por lo menos, los átomos, las moléculas o los iones de una sustancia se transforman en átomos, moléculas o iones de otra sustancia química distinta. Las reacciones químicas se escriben de forma simplificada mediante ecuaciones químicas.
Ajuste de las ecuaciones químicas:
Para ajustar una ecuación química hay que seguir el orden siguiente:
- Primero se ajustan los átomos de los metales, teniendo prioridad los más pesados.
- A continuación se ajustan los no metales, teniendo también prioridad los más pesados.
- Se revisa, si es necesario, el ajuste de los metales.
- Se comprueba el ajuste contando los átomos de hidrógeno y de oxígeno que intervienen.
Por ejemplo, para ajustar la reacción:
BaCl2 + Na2SO4 - NaCl + BaSO4
siguiendo el orden indicado:
- Se empieza por el metal Ba, que es el más pesado. Como en ambos miembros hay un átomo de bario, no es necesario ajustarlo. Se sigue por el otro metal, el Na. Dado que en el miembro de la izquierda hay dos átomos de Na debemos poner un 2 delante del NaCl de la derecha, quedando:
BaCl2 + Na2SO4 - 2 NaCl + BaSO4
- Se siguen ajustando los no metales: cloro y azufre. Como ambos ya están ajustados y en ambos miembros existe igual número de átomos de oxígeno, se puede considerar que la reacción ya está completamente ajustada.

COMO SE ESCRIBE UNA ECUACIÓN QUÍMICA
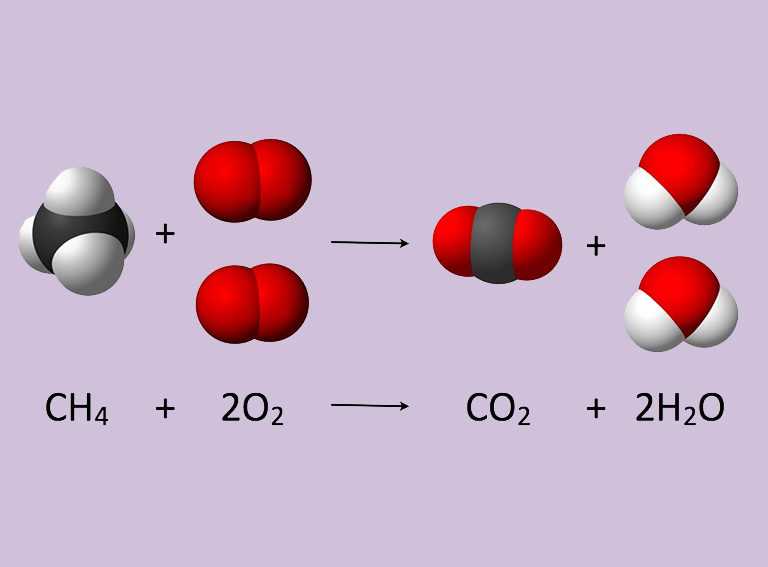
Se escribe en forma de ecuación sustituyendo el signo de igualdad (=) por una flecha (→) que indica el sentido de la misma.
Delante de cada fórmula se pone el número de unidades del elemento o del compuesto que intervienen en la reacción (excepto si ese número es 1) de manera que una vez completada, para cada elemento debe haber el mismo número de átomos en ambos términos. Por ejemplo, para indicar que cuando el carbono (C) se quema en presencia del oxígeno del aire (O2) se forma dióxido de carbono (CO2), se escribiría:C + O2 → CO2
Si queremos escribir la reacción entre el hidrógeno (H2) y el oxígeno (O2) para formar agua (H2O), pondremos:
2 H2 + O2 → 2 H2O
Y si queremos describir que la piedra caliza (carbonato de calcio: CaCO3) se descompone por el calor dando cal viva (óxido de calcio: CaO) y dióxido de carbono (CO2), tendríamos:
CaCO3 → CaO + CO2
TIPOS DE REACCIONES
- Reacciones de síntesis o combinación: Dos o más sustancias simples se combinan para dar un producto más complejo.
P4(s) + 3 O2 (g) → 2 P2O3 (g)

- Reacciones de descomposición: Un compuesto se transforma por acción del calor o de la electricidad en dos o más compuestos.
CaCO3 (s) → CaO (s) + CO2 (g)
- Reacciones de desplazamiento: Un elemento más activo reemplaza a otro menos activo en un compuesto.
Desplazamiento de la plata por el cobre
Cu (s) + AgNO3 (ac) → CuSO4 (ac) + Ag (s)
- Reacciones de doble desplazamiento: Particularmente comunes para reacciones iónicas en solución; se intercambian átomos o grupos atómicos para dar una sal insoluble.
Precipitación del yoduro de plomo
Pb(NO3)2 (ac) + NaI (ac) → PbI2 (s) + 2 NaNO3 (ac)

- Reacciones de oxidación y reducción, o reacción redox: Ocurren cuando algunos átomos experimentan un aumento en su estado de oxidación, proceso denominado oxidación y otros experimentan una disminución en su estado de oxidación, denominada reducción.
Reacción de un metal con un ácido
Zn (s) + 2 HCl (ac) → ZnCl2 (ac) + H2 (g)
El magnesio aumenta su número de oxidación de 0 a +2 y por lo tanto se oxida, a su vez el hidógeno del ácido disminuye su número de oxidación de +1 a 0, es decir se reduce. El Mg es el agente reductor y el HCl es el agente oxidante.
- Reacciones de neutralización o ácido-base: Cuando reacciona un ácido con una base para formar agua más un compuesto iónico llamado sal.
Ca(OH)2 (ac) + HCl(ac) → CaCl2 (ac) + 2 H2O (l)
COMO BALANCEAR UNA ECUACIÓN QUÍMICA?
Método de inspección

Un coeficiente indica el menor número de partículas de la sustancia involucrada en la reacción.
Para realizar el balance por inspección de una ecuación química debes de llevar a cabo los siguientes pasos:
PASO 1
Escribe la ecuación con la estructura básica para la reacción. Debes considerar la escritura adecuada de las fórmulas y símbolos de todas las sustancias participantes.

PASO 2
Cuenta los átomos de los elementos de los reactivos.

Participan:

PASO 3
Cuenta los átomos de los elementos de los productos.

Participan:

PASO 4
Coloca los coeficientes necesarios para que el número de átomos de cada elemento sea igual en ambos lados de la ecuación. Los coeficientes deben ser números enteros lo más pequeños posibles. NUNCA cambies los subíndices de una fórmula química para balancear la ecuación porque cambiarás la identidad química de la sustancia.
Como puedes observar, tanto en los reactivos como en los productos hay el mismo número de átomos de carbono y de oxígeno, en cambio el número de hidrógenos es diferente.


Para poder igualar el número de hidrógenos tanto en los reactivos como en los productos, se agrega un coeficiente 3 al hidrógeno de los reactivos:

Así entonces, de tener 2 hidrógenos, la fórmula de los reactivos consigue tener 6, tal como en los productos de la fórmula.

Como podrás observar, al colocar un coeficiente de 3 en el H2 la ecuación queda balanceada.

CONCLUSIONES
- Como podemos ver las reacciones químicas cotidianas tienen gran importancia en el entorno en que nos encontramos ya que sin ellas no podrían existir un sin numero de cosas.
- Sin las reacciones químicas no podríamos hacer tareas tan sencillas como lo son: el proceso de digestión o simplemente el poder respirar lo cual lo vemos como una tarea sencilla pero tiene una gran importancia y esto es resultado un proceso químico.
- Se producen reacciones químicas en todo lugar y a todo momento: en la atmósfera, en las fábricas, en los vehículos o en nuestro organismo, en el ambiente, etc.
WEBGRAFIA
https://www.significados.com/reaccion-quimica/
https://definicion.de/reaccion-quimica/
http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
https://clickmica.fundaciondescubre.es/conoce/100-preguntas-100-respuestas/se-escribe-una-reaccion-quimica/
https://portalacademico.cch.unam.mx/alumno/quimica1/unidad1/reaccionesQuimicas/ecuacionquimica

BUEN TRABAJO 4.8
ResponderEliminar