LABORATORIO DE GASES
LEY DE LOS GASES
LABORATORIO
INTRODUCCIÓN
Este informe tiene como finalidad instruir a las personas acerca de las leyes de los gases. Se hablara de distintos temas y en su marco teórico se lograra adquirir nuevos conocimientos, finalmente se pondrá en practica con la realización de ciertos ejercicios.
OBJETIVOS
- Permitir que el estudiante aprenda de una forma didáctica y entretenida la ley de los gases y su respectiva practica.
- Familiarizar al estudiante con las diferentes leyes, (Ley de boyle, Ley de charles) para que las pueda aplicar y comprender.
- Identificar las leyes de los gases en cualquier ámbito.
MARCO TEÓRICO
LEY DE BOYLE
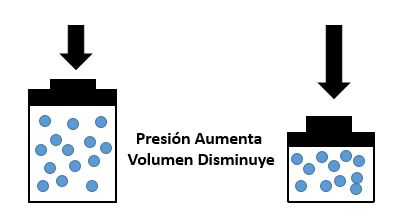
El volumen es inversamente proporcional a la presión: Si la presión aumenta, el volumen disminuye. Si la presión disminuye, el volumen aumenta.
HISTORIA
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte. La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. La expresión matemática de la ley de Boyle indica que el producto de la presión de un gas por su volumen es constante:
PV= K
P1V1= P2V2
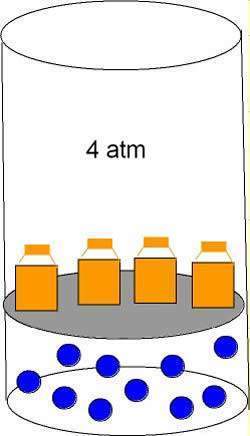
Como muestra la figura 1, Cuando se somete un gas a una presión de 4 atmósferas el volumen del gas disminuye. Por lo tanto, A mayor presión menor volumen
Figura 1. Gas sometido a presión de 4 atmosferas.
En la figura 2, se observa que cuando se disminuye la presión a 1 atmósfera, el volumen aumenta, debido a que los gases son compresibles. Por lo tanto A menor presión Mayor volumen.
Figura 2. Gas sometido a presión de 1 atmósfera.
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
la expresión matemática de esta ley es:
P⋅V=k
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
P1⋅V1=P2⋅V2
que es otra manera de expresar la ley de Boyle.
EJERCICIO LEY DE BOYLE
Solución: Lo primero que vamos analizar para la resolución del problema, son nuestros datos, saber que tenemos y que nos hace falta.
Por lo que podemos observar el problema nos pide el volumen final es decir 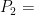 , vamos a utilizar la fórmula de Boyle-Mariotte e iniciaremos a despejar la variable que necesitamos para poder iniciar a resolver el problema.
, vamos a utilizar la fórmula de Boyle-Mariotte e iniciaremos a despejar la variable que necesitamos para poder iniciar a resolver el problema.
Despejando >> 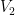
Sustituyendo nuestros datos.
Por lo que nuestro volumen final es de  litros.
litros.
Con esto podemos concluir que mientras la presión bajó el volumen aumentó.
Nacido en 1627, el menor de los catorce hijos del conde de Cork, estudió en las mejores universidades de Europa. Descubrió los indicadores, sustancias que permiten distinguir los ácidos de las bases. En 1659, con la ayuda de Robert Hooke, descubrió la ley que rige el comportamiento de los muelles, perfeccionó la bomba de aire para hacer el vacío que se utilizó en la minería para eliminar el agua de las galerías en las que trabajan los mineros.
Atacó a la Alquimia y a los alquimistas, que anunciaban que podían convertir cualquier metal en oro.
Definió la Química como una ciencia y enunció la primera definición moderna de elemento químico, como sustancia que no es posible descomponer en otras.
En 1661 publicó el primer libro moderno de química El Químico Escéptico en el que explicaba la mayoría de sus descubrimientos. Fue miembro de la Royal Society, institución que perdura en la actualidad, y participó activamente en sus reuniones hasta su fallecimiento.
En 1660, en una obra titulada Sobre la Elasticidad del Aire anunció su descubrimiento sobre la relación entre el volumen de un gas y su presión.
Parece que Boyle no especificó en sus trabajos que sus experiencias de la relación entre el volumen y presión los realiza a temperatura constante, quizá porque lo hizo así y lo dió por supuesto. Lo cierto es que, en defensa del rigor científico, hay que esperar a que en 1676 otro físico, el francés Edme Mariotte (1630-1684), encuentre de nuevo los mismos resultados y aclare que la relación PV=constante es sólo válida si se mantiene constante la temperatura. Por eso la ley de Boyle está referenciada en muchas ocasiones como Ley de Boyle y Mariotte.
LEY DE CHARLES
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y enunció la ley de los gases que lleva su nombre.

Fórmula de la ley de Charles
Cuando se desean estudiar dos diferentes estados, uno inicial y una final de un gas y evaluar el cambio de volumen en función de la temperatura o viceversa, se puede utilizar la fórmula:
V1 / T1 = V2 / T2
y despejar según la incógnita que se desee resolver.
POR QUE SUCEDE ESTO?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
VT=k
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
VT=k
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
BIOGRAFIA DE CHARLES
Charles Robert Darwin [ tʃɑrlz 'dɑː.wɪn (?·i)] (Shrewsbury, 12 de febrero de 1809 – Down House, 19 de abril de 1882) fue un naturalistainglés, reconocido por ser el científico más influyente (y el primero, compartiendo este logro de forma independiente con Alfred Russel Wallace) de los que plantearon la idea de la evolución biológica a través de la selección natural, justificándola en su obra de 1859 El origen de las especies con numerosos ejemplos extraídos de la observación de la naturaleza. Postuló que todas las especies de seres vivos han evolucionado con el tiempo a partir de un antepasado común mediante un proceso denominado selección natural. La evolución fue aceptada como un hecho por la comunidad científica y por buena parte del público en vida de Darwin, mientras que su teoría de la evolución mediante selección natural no fue considerada como la explicación primaria del proceso evolutivo hasta los años 1930.[1] Actualmente constituye la base de la síntesis evolutiva moderna. Con sus modificaciones, los descubrimientos científicos de Darwin aún siguen siendo el acta fundacional de la biología como ciencia, puesto que constituyen una explicación lógica que unifica las observaciones sobre la diversidad de la vida.[2]
tʃɑrlz 'dɑː.wɪn (?·i)] (Shrewsbury, 12 de febrero de 1809 – Down House, 19 de abril de 1882) fue un naturalistainglés, reconocido por ser el científico más influyente (y el primero, compartiendo este logro de forma independiente con Alfred Russel Wallace) de los que plantearon la idea de la evolución biológica a través de la selección natural, justificándola en su obra de 1859 El origen de las especies con numerosos ejemplos extraídos de la observación de la naturaleza. Postuló que todas las especies de seres vivos han evolucionado con el tiempo a partir de un antepasado común mediante un proceso denominado selección natural. La evolución fue aceptada como un hecho por la comunidad científica y por buena parte del público en vida de Darwin, mientras que su teoría de la evolución mediante selección natural no fue considerada como la explicación primaria del proceso evolutivo hasta los años 1930.[1] Actualmente constituye la base de la síntesis evolutiva moderna. Con sus modificaciones, los descubrimientos científicos de Darwin aún siguen siendo el acta fundacional de la biología como ciencia, puesto que constituyen una explicación lógica que unifica las observaciones sobre la diversidad de la vida.[2]
1. Si se tienen 0,2 litros de un gas a 30 °C y 1 atm de presión ¿Qué temperatura debería alcanzar para que aumente a 0,3 litros?
Los datos son:
V1 = 0,2L
T1 = 30 °C = 303,15 K (que se obtiene sumando 30 + 273,15)
P1 = P2 = 1 atm
V2 = o,3L
T2 = ?
T1 = 30 °C = 303,15 K (que se obtiene sumando 30 + 273,15)
P1 = P2 = 1 atm
V2 = o,3L
T2 = ?
T1 . V2 / V1 = T2(303,15 K . 0.3L) / 0,2L = T2 = 454,7 K = (454,7 – 273,15) = 181,55°C
2. Un gas a una temperatura de -164 ºC, ocupa un volumen de 7,5 litros . Si la presión permanece constante, calcular el volumen inicial sabiendo que la temperatura inicial era de -195 ºC.
V1 / T1 = V2 / T2
V1 = ?
T1 = -195 ºC = 78,15 K
V2 = 7,5 L
T2 = -164 ºC = 109,15 K
T1 = -195 ºC = 78,15 K
V2 = 7,5 L
T2 = -164 ºC = 109,15 K
V1 = V2 . T1 / T2
(7,5 . 78,15) / 109,15 = 5,35 L
LABORATORIO
EJERCICIOS
https://www.ecured.cu/Ley_de_Boyle-Mariotte
http://www.educaplus.org/gases/bio_boyle.html
https://www.fisimat.com.mx/ley-de-boyle-mariotte/
https://iquimicas.com/ley-de-charles-explicacion-y-ejercicios/
http://www.educaplus.org/gases/ley_charles.html














Y LOS DE ECUACION DE ESTADO Y COMO LOS RESOLVIO? 3.8
ResponderEliminar